Metalowa więź: mechanizm edukacji. Metalowe wiązania chemiczne: przykłady
Wszystkie obecnie znane chemikaliaelementy znajdujące się w układzie okresowym podzielono na dwie duże grupy: metale i niemetale. Aby stały się nie tylko pierwiastkami, ale związkami, chemikaliami, aby współdziałać ze sobą, muszą istnieć jako proste i złożone substancje.
Tylko w tym celu elektrony próbujązaakceptować, a inni dać. Uzupełniając się w ten sposób, elementy i tworzą różne cząsteczki chemiczne. Ale co pozwala im zostać razem? Dlaczego istnieją substancje o takiej sile, które nie mogą zostać zniszczone nawet przez najpoważniejsze narzędzia? A inni, wręcz przeciwnie, są niszczeni przy najmniejszym uderzeniu. Wszystko to jest spowodowane tworzeniem się różnego rodzaju wiązań chemicznych między atomami w cząsteczkach, tworzeniem sieci krystalicznej o pewnej strukturze.

Rodzaje wiązań chemicznych w związkach
Łącznie istnieją 4 główne typy wiązań chemicznych.
- Kowalencyjne niepolarne. Powstaje pomiędzy dwoma identycznymi niemetalami ze względu na uspołecznienie elektronów, tworzenie wspólnych par elektronowych. Nieprzydatne cząsteczki Valence biorą udział w jego tworzeniu. Przykłady: chlorowce, tlen, wodór, azot, siarka, fosfor.
- Kowalencyjnie polarny. Powstaje pomiędzy dwoma różnymi niemetaliami lub między bardzo słabym metalem we właściwościach i niemetalicznym słabym w elektroujemstwie. Opiera się również na zwykłych parach elektronów i przyciąga je do siebie atomem, a powinowactwo do elektronu jest wyższe. Przykłady: NH3, SiC, P2O5 i inni.
- Wiązanie wodorowe. Najbardziej niestabilny i słaby, utworzony pomiędzy silnie elektroujemnym atomem jednej cząsteczki a dodatnim. Najczęściej występuje wtedy, gdy substancje rozpuszczają się w wodzie (alkohol, amoniak i tak dalej). Dzięki temu połączeniu mogą istnieć makrocząsteczki białek, kwasów nukleinowych, złożonych węglowodanów i tak dalej.
- Wiązanie jonowe. Utworzone przez siły przyciągania elektrostatycznego różnie naładowanych jonów metali i niemetali. Im silniejsza różnica w tym wskaźniku, tym wyraźniejsza jest jonowa natura interakcji. Przykłady związków: sole binarne, związki kompleksowe - zasady, sole.
- Wiązanie metaliczne, którego mechanizm powstawania, a także właściwości, będzie rozpatrywane dalej. Formowane w metalach, ich stopy różnego rodzaju.
Jest coś takiego jak jedność chemiikomunikacja. Mówi się, że nie można uznać każdego wiązania chemicznego za odniesienie. Wszystkie są warunkowo wyznaczonymi jednostkami. W rzeczywistości podstawą wszystkich interakcji jest jedna zasada - oddziaływanie elektrono-statyczne. Dlatego jonowe, metaliczne, kowalencyjne wiązanie i wiązanie wodorowe mają jedną chemiczną naturę i są tylko wzajemnymi granicami.

Metale i ich właściwości fizyczne
Metale są przeważnie wśródwszystkie pierwiastki chemiczne. Wynika to z ich specjalnych właściwości. Znaczna część z nich została uzyskana przez reakcje jądrowe człowieka w laboratorium, są radioaktywne z krótkim okresem półtrwania.
Jednak większość to elementy naturalne,które tworzą całe skały i rudy, są częścią najważniejszych związków. To od nich ludzie nauczyli się rzucać stopy i produkować wiele pięknych i ważnych produktów. Są to takie jak miedź, żelazo, aluminium, srebro, złoto, chrom, mangan, nikiel, cynk, ołów i wiele innych.
Dla wszystkich metali można wyróżnić ogólne właściwości fizyczne, które są wyjaśnione przez schemat tworzenia wiązań metali. Jakie są te właściwości?
- Plastyczność i ciągliwość. Wiadomo, że wiele metali można zwijać nawet do stanu folii (złoto, aluminium). Inne otrzymują druty, elastyczne arkusze z metalu, produkty, które mogą zostać zdeformowane przez uderzenia fizyczne, a następnie natychmiast przywrócić kształt po zatrzymaniu. Właśnie te właściwości metali nazywane są plastycznością i plastycznością. Powodem tej funkcji jest metalowy rodzaj wiązania. Jony i elektrony w krysztale ślizgają się względem siebie bez zerwania, co pozwala zachować integralność całej struktury.
- Metaliczny połysk. Wyjaśnia także wiązanie metalu, mechanizm formowania, jego cechy i cechy. Zatem nie wszystkie cząstki mogą pochłaniać lub odbijać fale świetlne o tej samej długości. Atomy większości metali odbijają promienie krótkofalowe i uzyskują prawie taki sam kolor srebra, bieli, blado niebieskawego odcienia. Wyjątkami są miedź i złoto, ich kolor jest odpowiednio czerwono-czerwony i żółty. Są zdolne do odbijania większych długości fal.
- Przewodność cieplna i elektryczna. Właściwości te są również wyjaśnione przez strukturę sieci krystalicznej i fakt, że metaliczny typ wiązania jest realizowany w jej tworzeniu. Dzięki „gazowi elektronowemu” poruszającemu się wewnątrz kryształu, prąd elektryczny i ciepło są natychmiast i równomiernie rozłożone między wszystkie atomy i jony i są przenoszone przez metal.
- Stan stały w normalnych warunkach. Jedynym wyjątkiem jest rtęć. Wszystkie inne metale są koniecznie mocnymi, stałymi związkami, a także ich stopami. Jest również wynikiem wiązania metalicznego obecnego w metalach. Mechanizm powstawania tego typu cząstek wiążących w pełni potwierdza właściwości.
Są to podstawowe cechy fizyczne dlametale, co wyjaśnia i określa schemat tworzenia wiązania metalowego. Ta metoda łączenia atomów jest istotna dla elementów metali i ich stopów. To znaczy dla nich w stanie stałym i płynnym.

Metaliczny rodzaj wiązania chemicznego
Jaka jest jego funkcja? Faktem jest, że takie wiązanie powstaje nie kosztem różnie naładowanych jonów i ich przyciągania elektrostatycznego, a nie kosztem różnicy w elektroujemności i obecności wolnych par elektronów. Oznacza to, że wiązanie jonowe, metaliczne, kowalencyjne ma nieco inną naturę i charakterystyczne cechy cząsteczek, które mają być związane.
Wszystkie metale mają takie cechy, jak:
- niewielka liczba elektronów na poziomie energii zewnętrznej (z wyjątkiem pewnych wyjątków, które mogą mieć 6.7 i 8);
- duży promień atomowy;
- niska energia jonizacji.
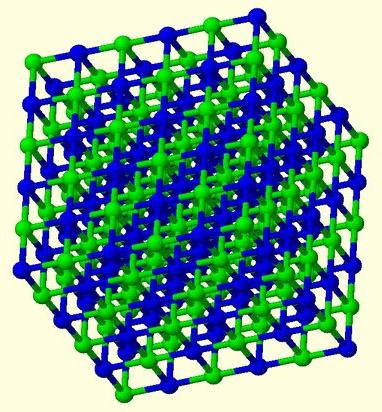
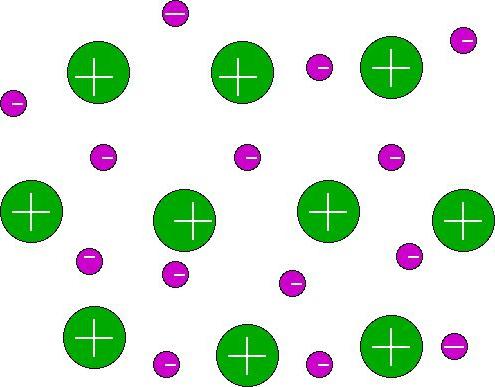
Wszystko to przyczynia się do łatwego oddzielenia zewnętrznegoniesparowane elektrony z jądra. W tym samym czasie atom ma wiele bezpłatnych orbitali. Schemat tworzenia wiązania metalicznego pokaże po prostu nakładanie się wielu komórek orbitalnych różnych atomów między sobą, co w rezultacie tworzy wspólną przestrzeń wewnątrzkrystaliczną. Wprowadzane są do niego elektrony z każdego atomu, które zaczynają swobodnie wędrować w różnych częściach sieci. Okresowo każdy z nich łączy się z jonem w węźle kryształu i zamienia go w atom, a następnie ponownie rozłącza, tworząc jon.
Tak więc wiązanie metalu jest wiązaniem.między atomami, jonami i elektronami swobodnymi w zwykłym krysztale metalu. Chmura elektronów, która porusza się swobodnie w strukturze, nazywana jest „gazem elektronowym”. Wytłumaczono im większość właściwości fizycznych metali i ich stopów.
Jak dokładnie sam metalwiązanie chemiczne? Przykłady mogą być różne. Spróbujmy zastanowić się nad kawałkiem litu. Nawet jeśli przyjmiesz rozmiar grochu, będą tysiące atomów. Wyobraźmy sobie zatem, że każdy z tych tysięcy atomów oddaje swój własny elektron walencyjny do wspólnej przestrzeni krystalicznej. Jednocześnie, znając elektroniczną strukturę tego elementu, można zobaczyć liczbę pustych orbitali. Lit będzie miał 3 z nich (orbitale p drugiego poziomu energii). Trzy z każdego atomu na dziesiątki tysięcy - to wspólna przestrzeń wewnątrz kryształu, w której „gaz elektronowy” porusza się swobodnie.

Substancja z metalicznym wiązaniem jest zawsze mocna. Wszakże gaz elektronowy nie pozwala na rozpad kryształu, ale jedynie przemieszcza warstwy i natychmiast przywraca. Świeci, ma określoną gęstość (najczęściej wysoką), topliwość, plastyczność i plastyczność.
Gdzie jeszcze jest realizowana metalowa więź? Przykłady substancji:
- metale w postaci prostych struktur;
- wszystkie stopy metali ze sobą;
- wszystkie metale i ich stopy w stanie ciekłym i stałym.
Konkretne przykłady mogą być tylko niesamowitą ilością, ponieważ w układzie okresowym jest ponad 80 metali!
Metalowe wiązanie: mechanizm formowania
Jeśli weźmiemy to pod uwagę w kategoriach ogólnych, głównymomenty, które już zidentyfikowaliśmy powyżej. Obecność wolnych orbitali atomowych i elektronów, które łatwo odrywają się od jądra dzięki niskiej energii jonizacji, są głównymi warunkami tworzenia tego typu wiązania. Okazuje się więc, że jest realizowany między następującymi cząstkami:
- atomy w miejscach sieci;
- wolne elektrony, które były metalem walencyjnym;
- jony w sieciach kratowych.
Rezultatem jest metalowa spoina. Mechanizm kształcenia w formie ogólnej wyraża następujący wpis: Ja0 - e- ↔ Men +. Z tego schematu jest oczywiste, które cząstki występują w krysztale metalu.
Same kryształy mogą mieć inny kształt. To zależy od konkretnej substancji, z którą mamy do czynienia.
Rodzaje kryształów metali
Struktura metalu lub jego stopucharakteryzuje się bardzo gęstym upakowaniem cząstek. Dostarcza jonów w węzłach kryształu. Same kraty mogą mieć różne formy geometryczne w przestrzeni.
- Sześcienna siatka skoncentrowana na ciele - metale alkaliczne.
- Sześciokątna zwarta struktura - cała ziemia alkaliczna, z wyjątkiem baru.
- Granulocentryczny sześcienny - aluminium, miedź, cynk, wiele metali przejściowych.
- Struktura romboedryczna jest w rtęci.
- Tetragonalna - ind.
Im cięższy jest metal, tym niższy jest umieszczonyukład okresowy, tym trudniejsze jest jego pakowanie i przestrzenna organizacja kryształu. W tym przypadku wiązanie chemiczne metalu, którego przykłady można podać dla każdego istniejącego metalu, ma decydujące znaczenie w konstrukcji kryształu. Stopy mają bardzo różnorodne organizacje w kosmosie, niektóre z nich nie zostały jeszcze w pełni zbadane.

Charakterystyka komunikacji: brak kierunkowości
Wiązania kowalencyjne i metaliczne mają jednobardzo wyraźna cecha wyróżniająca. W przeciwieństwie do pierwszego, wiązanie metalu nie jest kierunkowe. Co to znaczy? Oznacza to, że chmura elektronów wewnątrz kryształu przemieszcza się całkowicie swobodnie w obrębie swoich granic w różnych kierunkach, każdy z elektronów jest w stanie połączyć absolutnie każdy jon w węzłach struktury. Oznacza to, że interakcja odbywa się w różnych kierunkach. Stąd mówią, że wiązanie metalu jest bezkierunkowe.
Mechanizm wiązania kowalencyjnego implikujepowstawanie wspólnych par elektronów, to jest zachodzących na siebie chmur atomów. I dzieje się to ściśle wzdłuż pewnej linii łączącej ich centra. Dlatego mówią o kierunku takiego połączenia.
Nasycenie
Ta cecha odzwierciedla zdolność atomówograniczona lub nieograniczona interakcja z innymi. W ten sposób wiązania kowalencyjne i metalowe w tym wskaźniku są znowu przeciwieństwami.
Pierwszy jest nasycalny. Atomy uczestniczące w jego tworzeniu mają ściśle określoną liczbę elektronów zewnętrznych walencyjnych bezpośrednio zaangażowanych w tworzenie związku. Nie ma więcej elektronów niż on. Dlatego liczba utworzonych obligacji jest ograniczona przez wartościowość. Stąd nasycalność komunikacji. Ze względu na tę cechę większość związków ma stały skład chemiczny.
Przeciwnie, wiązania metalowe i wodorowe,nienasycony. Wynika to z obecności licznych wolnych elektronów i orbitali w krysztale. Również rolę odgrywają jony w miejscach sieci, z których każdy może stać się atomem i ponownie jonem w danym momencie.

Inną cechą łączenia metalu jestdelokalizacja wewnętrznej chmury elektronów. Przejawia się w zdolności małej liczby wspólnych elektronów do wiązania wielu jąder atomowych metali. Oznacza to, że gęstość, jakby była, jest zdelokalizowana, rozłożona równomiernie między wszystkie ogniwa kryształu.
Przykłady wiązania w metalach
Rozważmy kilka konkretnych opcji, które ilustrują, jak powstaje wiązanie metaliczne. Przykłady substancji są następujące:
- cynk;
- aluminium;
- potas;
- chrom.
Tworzenie wiązania metalicznego między atomami cynku: Zn0 - 2e- ↔ Zn2+. Atom cynku ma cztery poziomy energii. Darmowe orbitale, oparte na strukturze elektronicznej, mają 15–3 na p-orbitali, 5 na 4 d i 7 na 4f. Struktura elektroniczna jest następująca: 1s22s22p63s23p6hc23d104p04d04f0 W sumie 30 elektronów w atomie. Oznacza to, że dwie wolne cząstki ujemne wartościowości mogą poruszać się w obrębie 15 przestronnych orbitalów lub nikt nie jest zajęty. I tak na każdym atomie. Rezultat - ogromna wspólna przestrzeń, składająca się z pustych orbitali i niewielkiej liczby elektronów, łącząca całą strukturę razem.
Metalowe wiązanie między atomami aluminium: AL0 - e- ↔ AL3+ . Trzynaście elektronów atomu glinu znajduje się na trzech poziomach energetycznych, których wyraźnie brakuje. Struktura elektroniczna: 1s22s22p63s23p13d0. Darmowe orbitale - 7 sztuk. Oczywiście, chmura elektronów będzie mała w porównaniu z całkowitą wewnętrzną wolną przestrzenią w krysztale.

Wiązanie chromu metalicznego. Ten element ma specjalną strukturę elektroniczną. W końcu, aby ustabilizować system, elektron zawiedzie od 4s do 3d orbital: 1s22s22p63s23p6hc13d54p04d04f0. Tylko 24 elektrony o wartościowościokazuje się sześć. To oni wchodzą do ogólnej przestrzeni elektronicznej, tworząc wiązanie chemiczne. Istnieje 15 darmowych orbitali, czyli nadal jest dużo więcej niż jest to wymagane do wypełnienia. Dlatego też chrom jest typowym przykładem metalu z odpowiednim wiązaniem w cząsteczce.
Jedna z najbardziej aktywnych reakcji metalinawet zwykłą wodą z ogniem jest potas. Co wyjaśnia takie właściwości? Ponownie, pod wieloma względami - metaliczny typ połączenia. Ten element ma tylko 19 elektronów, ale teraz znajduje się na 4 poziomach energii. Oznacza to, że na 30 orbitale różnych podpoziomów. Struktura elektroniczna: 1s22s22p63s23p6hc13d04p04d04f0. Tylko dwa elektrony walencyjne, z bardzo niskimenergia jonizacji. Zejdź swobodnie i przejdź do wspólnej przestrzeni elektronicznej. Orbitale do poruszania się na jednym atomie to 22 części, czyli bardzo rozległa wolna przestrzeń dla „gazu elektronowego”.
Podobieństwa i różnice z innymi typami połączeń
Ogólnie rzecz biorąc, problem ten został już omówiony powyżej. Możesz podsumować i wyciągnąć wnioski. Głównymi cechami odróżniającymi kryształy metaliczne od wszystkich innych rodzajów wiązania są:
- kilka rodzajów cząstek zaangażowanych w proces wiązania (atomy, jony lub jony atomowe, elektrony);
- różne przestrzenne struktury geometryczne kryształów.
Z wodorem i jonowym wiązaniem metalicznymłączy nienasycenie i brak kierunkowości. Z kowalencyjnym biegunem - silne przyciąganie elektrostatyczne między cząstkami. Oddzielnie jonowe - rodzaj cząstek w węzłach sieci krystalicznej (jony). Z kowalencyjnymi niepolarnymi atomami w węzłach kryształu.
Rodzaje wiązań w metalach o różnym stanie agregacji
Jak zauważyliśmy powyżej, metaliczne wiązanie chemiczne, którego przykłady podano w artykule, powstaje w dwóch stanach agregacji metali i ich stopów: ciała stałego i cieczy.
Powstaje pytanie: Jaki rodzaj wiązania w oparach metali? Odpowiedź: kowalencyjny polarny i niepolarny. Jak we wszystkich związkach w postaci gazu. Oznacza to, że przy długotrwałym ogrzewaniu metalu i jego przeniesieniu ze stałego do ciekłego wiązania, nie pęka i struktura krystaliczna zostaje zachowana. Jednakże, jeśli chodzi o przenoszenie cieczy do stanu pary, kryształ ulega zniszczeniu, a wiązanie metalu przekształca się w wiązanie kowalencyjne.
</ p>>